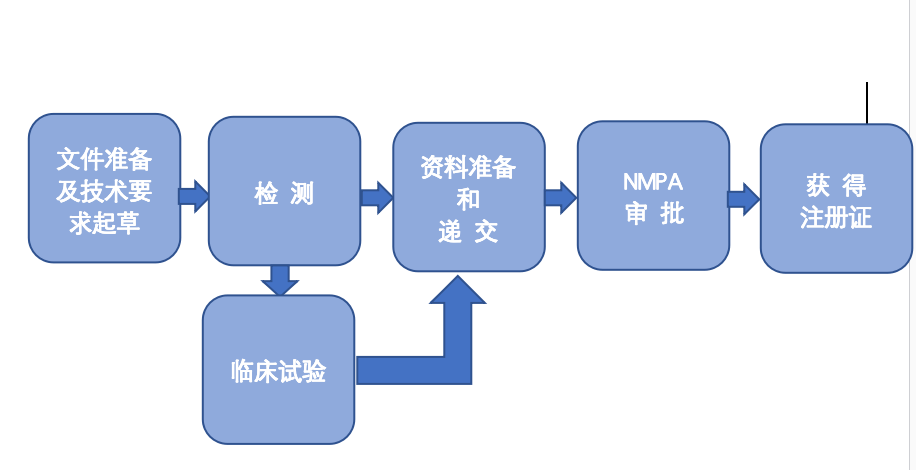
爱尔默为您提供各种专业的医疗器械代理注册服务。我们的医疗器械注册团队为客户提供专业的医疗器械注册服务:包括技术要求的撰写、产品注册检测、注册资料的整理递交及注册的全程跟进。
为规范医疗器械的注册与备案管理,保证医疗器械的安全、有效。国内外及港、澳、台地区的医疗器械需要申请获得中国国家药品监督管理局颁发的"医疗器械注册证",才可以在中国市场销售。
注册申请的过程需要遵照中华人民共和国医疗器械监督管理条例和医疗器械注册与备案管理办法。 国家药品监督管理局依据这两项法律法规中的相关规定对进口医疗器械的注册申请进行管理和审批。
《医疗器械监督管理条例》(国务院令第739号)自2021年6月1日起施行,《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)自2014年10月1日起施行。

国家对医疗器械按照风险程度实行分类管理。
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
第一类医疗器械实行备案管理。第二类、第三类医疗器械实行注册管理。
境内第一类医疗器械备案,备案人向设区的市级食品药品监督管理部门提交备案资料。
境内第二类医疗器械由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。
境内第三类医疗器械由国家药品监督管理局审查,批准后发给医疗器械注册证。
进口第一类医疗器械备案,备案人向国家药品监督管理局提交备案资料。
进口第二类、第三类医疗器械由国家药品监督管理局审查,批准后发给医疗器械注册证。
香港、澳门、台湾地区医疗器械的注册、备案,参照进口医疗器械办理。
注册和备案需要提交检验报告,提交的医疗器械产品检验报告可以是自检报告,也可以是委托有资质的医疗器械检验机构出具的检验报告。
医疗器械注册是药品监督管理部门根据医疗器械注册申请人的申请,依照法定程序,对其拟上市医疗器械的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。
医疗器械注册包括资料的准备和注册申报:
1. 筛选资料,提供资料目录清单,告知客户还需要进一步准备的资料情况。
2. 根据NMPA有关注册和资料格式的要求,翻译、整理、制作完成符合申报要求的注册资料。
3. 完成注册产品标准的申报审批、产品检测和产品注册申报工作。